Nouvelles pistes sur les cinétiques de cristallisation des carbonates aux interfaces
Une étude internationale, incluant des chercheurs de l’Institut des sciences de la Terre (ISTERRE, CNRS/Université Mont-Blanc Savoie/IRD/IFSTTAR/Université Grenoble-Alpes) et du laboratoire Physicochimie des électrolytes et nanosystèmes interfaciaux (PHENIX, CNRS/Sorbonne Université), montre comment la formation des minéraux carbonatées est régulée par les propriétés du substrat. Un résultat pertinent dans l’étude des processus de cristallisation, aussi bien en milieu géologique qu’industriel.
La formation de minéraux à partir de solutions aqueuses est un phénomène naturel qui impacte les transferts de masse à l'intérieur de la lithosphère, avec un effet sur le cycle des éléments - principalement par le biais d'interactions avec le vivant. Les phénomènes de cristallisation ont aussi une grande importance industrielle, par exemple, pour le développement de nouveaux agents anti-tartre ou dans la synthèse de matériaux biomimétiques.
Le processus de formation des minéraux comporte habituellement deux étapes consécutives – la nucléation et la croissance – qui sont contrôlées par des interactions complexes entre différents facteurs environnementaux. Au cours des dernières années, de nombreuses preuves de l'existence généralisée d’une voie de nucléation dite « non classique » sont apparues. Cette voie implique la formation de phases désordonnées ou nanocristallines au cours des premières étapes du processus de cristallisation, qui s'agrègent et/ou recristallisent ensuite pour former la phase cristalline finale (voir Figure 1). Ces voies sont couramment observées au cours des premiers stades de la formation des biominéraux. Dans le cas des biominéraux de carbonate de calcium, un intermédiaire amorphe - carbonate de calcium amorphe, ACC - est formé pendant les premiers stades de développement, permettant aux organismes de produire les formes complexes de leurs coquilles et squelettes. Cet intermédiaire amorphe cristallise ensuite, en formant des biominéraux de calcite (p. ex., les spicules de l’oursin) ou d'aragonite (p. ex., le nacre des huitres perlières).
Pour que le processus de bio-minéralisation soit efficace, la cinétique de cristallisation du précurseur du carbonate de calcium amorphe doit être contrôlée de manière très fine. Ceci se fait par le biais d'interactions avec des molécules et ions organiques et inorganiques -additifs-, et avec des interfaces organiques qui fournissent des loci pour la nucléation et la croissance de la phase minérale. Cependant, le mécanisme précis qui contrôle la cinétique de cristallisation de l'ACC dans ces systèmes naturels reste inconnu.
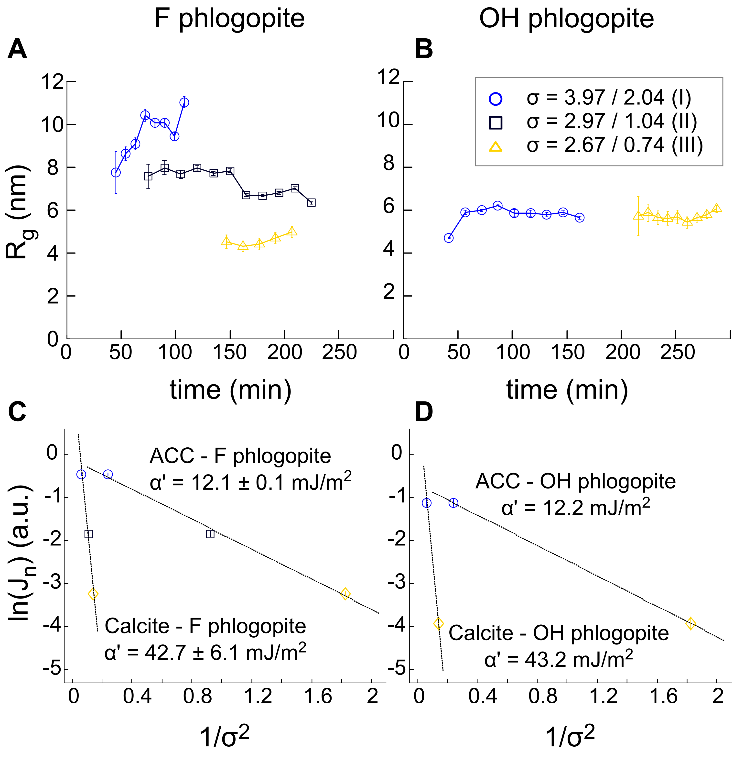
Le projet EC2CO " Nucléation " (financé par l'INSU) s’est attaqué à ce problème. Le projet comprenait un groupe de chercheurs de l'ISTerre (Grenoble), en collaboration avec le laboratoire PHENIX (Paris) et l'Université Complutense (Madrid, Espagne). Le but du projet était de déterminer l'influence de l'hydrophobicité d'un substrat sur la formation hétérogène de carbonate de calcium. A cet effet, un ensemble d'échantillons de mica (phlogopite) d’hydrophilicités différentes (modulé par des substitutions F- par OH- dans leur structure) a été obtenu de la Collection Jussieu, Musée National d'Histoire Naturelle (Paris, France) et de H. C. Materials Corporation (IL, USA). Ces échantillons sont des systèmes modèles qui fournissent des loci de nucléation pour le carbonate de calcium, avec des propriétés de mouillage très différentes: les échantillons hydroxylés sont hydrophiles et les échantillons fluorés sont hydrophobes. Des expériences in situ ont été réalisées à l'aide d'une technique synchrotron sensible à la surface qui a permis d'observer les premiers stades de la formation d'ACC sur les substrats de mica (Figure 1). Ces expériences ont été combinées à des expériences d'imagerie en microscopie à force atomique et de spectroscopie infrarouge qui ont permis de caractériser les cinétiques de cristallisation.
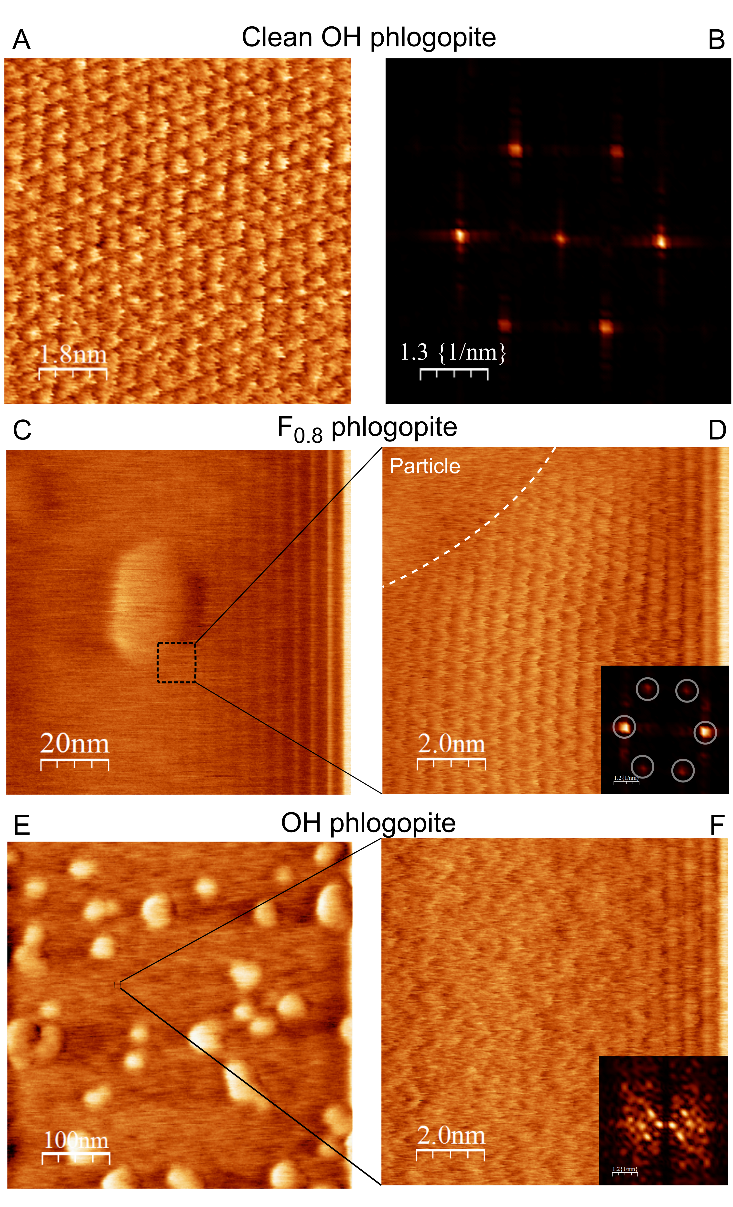
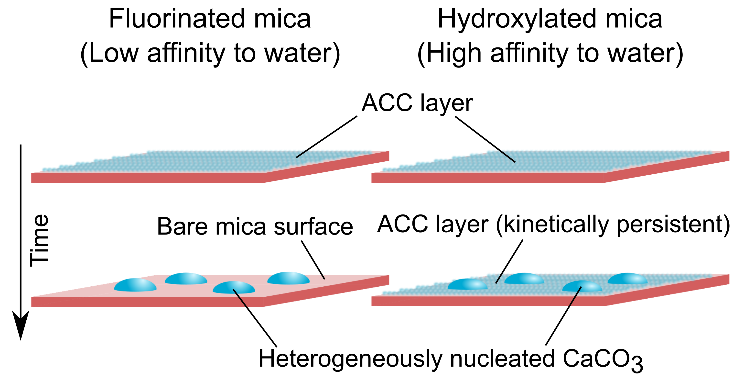
Les résultats montrent un comportement contrasté entre les substrats hydrophiles (OH-phlogopite) et hydrophobes (F-phlogopite) : le précipité de carbonate de calcium amorphe est plus persistant sur la surface hydroxylée (hydrophile) que sur celle fluorée (hydrophobe). En effet, les images AFM montrent que, alors que des cristaux de calcite isolés se forment sur le phlogopite hydrophobe, une couche d'ACC persiste plus longtemps sur le substrat de phlogopite hydrophile, retardant ainsi la cristallisation (Figures 2 et 3). Ce résultat peut être rationalisé par le caractère hautement hydraté du précipité ACC, qui pourrait être responsable de sa durée de vie plus longue par la formation de liaisons hydrogène avec le substrat hydrophile.
Ces résultats soulignent l'importance des propriétés de mouillage d'un substrat pendant le processus de cristallisation. Ils fournissent une base de référence pour d'autres études sur les organismes bio-minéralisants : des interfaces organiques aux propriétés de mouillage contrastées sont présentes dans les matrices organiques, ce qui pourrait fournir un moyen de réguler la cinétique de cristallisation pendant le processus de bio-minéralisation. Ces résultats sont également pertinents dans d’autres processus de cristallisation, tels que le transport de fluides réactifs en milieu géologique et industriel.
Source
Ayumi Koishi, Alejandro Fernandez-Martinez, Alexander E. S. Van Driessche, Laurent J. Michot, Carlos M. Pina, Carlos Pimentel, Byeongdu Lee, German Montes-Hernandez. Surface wetting controls calcium carbonate crystallization kinetics. Chemistry of Materials (2019) doi: 10.1021/acs.chemmater.9b00417
